Triterpenes
Les triterpenes aussi comme mono-, seskvi-, di-, sester- et tetra- forment un grande sous-groupe des matieres végétales - des terpenes qui sont largement étendues non seulement dans les végétaux supérieurs mais dans les cas uniques aussi dans les organismes maritimes, dans le moisissures, les microoganismes ou rarement dans les bolets. Les terpenes ensemble avec les steroides completent le domaine étendu des isoprenes. Du nom suit que la pierre fondamentale de construction de toutes les isoprenes est l'isoprene (2-methylbut-1,3-dien). La biosynthese des triterpenes vient de squalene. Des monoterpenes (deux unités fondamentales) par ex. kafr, borneol, menthol, pinen, limonen, karvon, citronelol, jasmon, terpinen, terpineol, geranoil, partiellement aussi des seskviterpenes (trois unités fondamentales) par ex. jonones, methyljonones, iron, nerolidol, farnesol, cedrol, karyolylen incarnent des représentants des odeurs végétales parce qu'ils forment une grande partie des essences et des résines, mais sester-, tetra- et triterpenes sont surtout les matieres solides qui se trouvent dans la nature libres ou liées dans la forme des esteres ou glycosides.
Jusqu'a présent on a isolé des sources végétales plus de 30 000 terpenes, cela comporte 4000 triterpenes dérivés de plus de 40 types de scelettes. La palette des activités biologiques des terpenes est incroyablement large et comporte par ex. des activités: anti-microbienne (acide fuside et helvole), anti-fidant (radermasinis), anti-mycotiques (trianthenol), antivirale (les dérivés de l'acide betulinique), anti-enflammée (les dérivés de l'acide boswellique, platycodin D, betulin, lupeol), des effets anti-tumorales (des acides betulinique, boswellique, pomole), anti-cariées (des acides oleanolique, glycyrrhetique), anti-angiogenne, anti-ulcerienne (des acides glycyrrhetique, ursolique, oleanolique), anti-allegiques (acide oleanolique), hepatoprotectifs (lupeol, acides ursoliques, oleanoliques), tonifiant les activités (des acides 24-hydroxytormenique et boswellique) et etc.
Cependent, quelques activités biologiques des triterpenes sont déja connues tres longtemps, surtout profitées dans la médecine orientale ou populaire (par ex. une écore de l'arbre brésilien, Ocotea suaveolens) est dans la médecine tradiotionnelle utilisée comme le soulagment la douleur, aussi comme le fortifiant et pour le traitement de l'asthme, c'est-a-dire leur potentiel pharmaceutique est pour le moment profité seulement d'une petite partie.
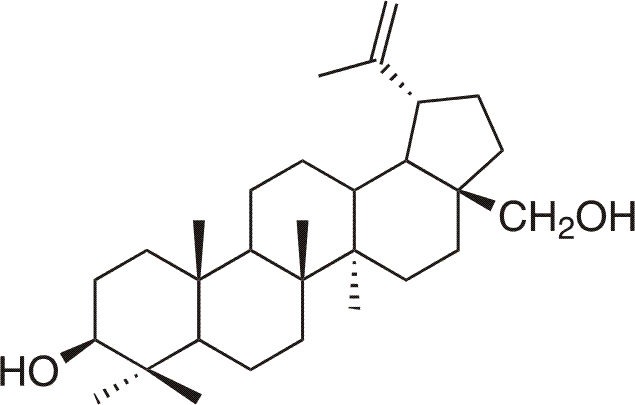 Le betulin est l'alcool naturel, pentacyclique de triterpene (lup-20(29)-en-3b,28-diol) qui est beaucoup représenté dans la nature, surtout dans l'écore du bouleau d'ou vient son nom. Le betulin a été l'un des triterpenes premieres, en 1788 Lowitz l'a acquis de l'écore du bouleau comme la propre substance chimique. En suivante, il a été acquit par l'extraction des couches de dessus de l'écorce du bouleau par l'ethanol. Mais plusieurs décennies ont duré quand sa structure a été bien déterminée. Au fond, la couleur blanche de l'écorce du bouleau est causée par la présence du betulin qui donne a l'écorce du bouleau des qualités spécifiques. Par ex.: l'écorce ne pourrit jamais, ne moisit jamais, cela est causé par les qualités du betulin: anti-moisies et anti-bactériennes.
On ne sait pas pourquoi les bouleaux synthétise le betulin et le dépose dans son écorce. Probablement il s'agit du moyen naturel contre les rongeurs et contre l'attaque des microorganismes. Mais le betulin et ses dérivés ont les autres effets biologiques intéressants, par ex. anti-enflammées, anti-virales, anti-SIDA, hepatoprotectifs et etc.
Le betulin est l'alcool naturel, pentacyclique de triterpene (lup-20(29)-en-3b,28-diol) qui est beaucoup représenté dans la nature, surtout dans l'écore du bouleau d'ou vient son nom. Le betulin a été l'un des triterpenes premieres, en 1788 Lowitz l'a acquis de l'écore du bouleau comme la propre substance chimique. En suivante, il a été acquit par l'extraction des couches de dessus de l'écorce du bouleau par l'ethanol. Mais plusieurs décennies ont duré quand sa structure a été bien déterminée. Au fond, la couleur blanche de l'écorce du bouleau est causée par la présence du betulin qui donne a l'écorce du bouleau des qualités spécifiques. Par ex.: l'écorce ne pourrit jamais, ne moisit jamais, cela est causé par les qualités du betulin: anti-moisies et anti-bactériennes.
On ne sait pas pourquoi les bouleaux synthétise le betulin et le dépose dans son écorce. Probablement il s'agit du moyen naturel contre les rongeurs et contre l'attaque des microorganismes. Mais le betulin et ses dérivés ont les autres effets biologiques intéressants, par ex. anti-enflammées, anti-virales, anti-SIDA, hepatoprotectifs et etc.
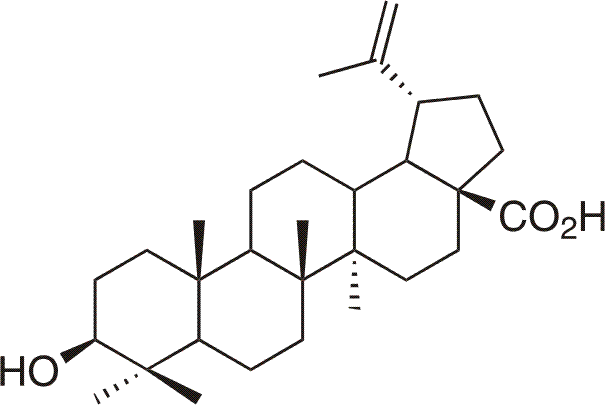 L'acide betulinique est l'acide naturelle pentacyclique (3b-hydroxylup-20(29)-en-28-acide) qui se trouve beaucoup dans la nature. Premierement elle a été isoleé en 1976 de Vanquelinia coymbosa, puis aussi de l'arbuste africain Ziziphus mauritianazam (Rhamnaceae) ou on peut l'acquérir de l'écorce du platane. On a accordé plus l'attention a l'acide betulinique qu'au betulin surtout grâce a son activité selective anti-tumorale a l'égard de cellules du melanom humaine. Quelques dérivés de l'acide betulinique montrent aussi les excellents anti-SIDA et les autres effets antivirales.
L'acide betulinique est l'acide naturelle pentacyclique (3b-hydroxylup-20(29)-en-28-acide) qui se trouve beaucoup dans la nature. Premierement elle a été isoleé en 1976 de Vanquelinia coymbosa, puis aussi de l'arbuste africain Ziziphus mauritianazam (Rhamnaceae) ou on peut l'acquérir de l'écorce du platane. On a accordé plus l'attention a l'acide betulinique qu'au betulin surtout grâce a son activité selective anti-tumorale a l'égard de cellules du melanom humaine. Quelques dérivés de l'acide betulinique montrent aussi les excellents anti-SIDA et les autres effets antivirales.
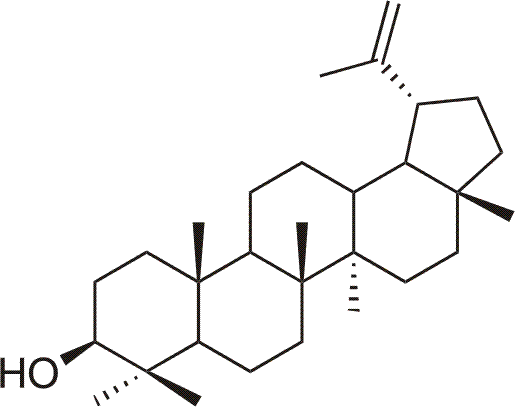 Le lupeol est l'alcool naturel pentacyclique de triterpene (lup-20(29)-en-3b-ol) qui se trouve dans la série des plantes médicinales ou des fruits (par ex. la pomme, la mangue), en plus de cela le lupeol accompagne le betulin dans la nature. Le lupeol montre les effets chimiopréventifs, cytotoxyques et anti-rongeurs et montre aussi l'action anti-oxydante et c'est le remede potentiel des maladies causées par des radicaux libres. Parmi les autres activités appartient l'effet antiangiogéne (de 30 ng/ml).
Le lupeol est l'alcool naturel pentacyclique de triterpene (lup-20(29)-en-3b-ol) qui se trouve dans la série des plantes médicinales ou des fruits (par ex. la pomme, la mangue), en plus de cela le lupeol accompagne le betulin dans la nature. Le lupeol montre les effets chimiopréventifs, cytotoxyques et anti-rongeurs et montre aussi l'action anti-oxydante et c'est le remede potentiel des maladies causées par des radicaux libres. Parmi les autres activités appartient l'effet antiangiogéne (de 30 ng/ml).
Les betulinines représentent le groupe des triterpenes préparées par J. Šarek dans les années 1999 - 2001 dans le groupe des matieres végétales au Département de la Chimie Organique, a la Faculté de Science, de l'Université Charles, dérivés de la squelette lupanique, des E-lupanique et 18a-oleananique qui disposent sauf les autres de l'activité importante anti-tumorale (IC50 < 5 µmol/l). En différence de la triterpene cytotoxyque connue le plus longtemps de l'acide betulinique n'est pas l'activité anti-tumorale du betulin fixées seulement sur les lignes de cellule de melanom (MeL-2). Les betulinines disposent de l'activité largespectrale anti-tumorale contre plusieurs lignes tumorales de l'origine différent histogénétique ensemble des multidrugs résistants, par ex. A549, Saos2, BT549, D1145, OVCAR-3, K562, U20S, CE etc. L'efficacité largespectrale des betulinines touche jusqu'aux cellules p53 négatif, pRb négatif sans égard sur leur origine histogénétique, toutefois elles montrent la toxicité plus basse contre les cellules nontumorales. Du contrôle morphologique des cultures tissés des cellules avec le composé le plus efficace - l'acide β-keto (3b,28-diacetoxy-19,20,21,29,30-pentanorlupan-22) qui montre sur la pluparte des lignes testées tumorales la cytotoxycité plus basse que 1µmol/l, découle que le mécanisme de l'effet est l'apoptose (la mort programmée de cellule), regardez l'image suivante.

Comme on a trouvé par la méthode de la cytometrie d'écoulement l'acide b-keto cause l'apoptose tres vite qui est meme plus vite que chez le paclitaxel chez un des cytostatiques convetionnels les plus efficaces. Selon les connaissances d'ajourd'hui le mécanisme de l'activation de l'apoptose est offert le plus souvent avec l'activation des cascades des caspases par la détente du cytochrome C, événtuellement AIF (l'apoptose le fracteur inductif).
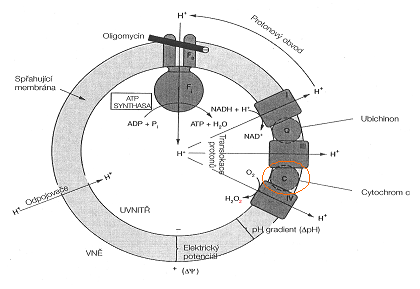
L'acide β-keto cause le blok en G1/S en phase du cycle de cellule. Sur la base des experiments derniers provient que ce composé a une capacité exceptionnelle de bloquer le dernier pas de la chaîne de respiration, en suivant mettre en marche la production du radical de péroxyde (le péroxyde d'hydrogene - regardez l'image). Il arrive a la blocation probablement grâce a la conjugaison directe de l'acide β-keto avec le cytochrome C. Il s'agit alors de l'atteinte dans la chaîne de respiration mitochondrielle, c'est-a-dire le but primaire des betulinines est localisé dans les mitochondres.
Literatura:
1. J. D. Connolly and R. A. Hill: Nat. Prod. Rep. 22, 230 (2005).2. J. D. Connolly and R. A. Hill, Nat. Prod. Rep. 22, 487 (2005).
3. Vonášek F., Trepková E., Novotný L.: Látky vonné a chuťové, SNTL, Praha 1987.
4. Dzubak P., Hajduch M., Vydra D., Hustova A., Kvasnica M., Biedermann D., Markova L., Urban M., Sarek J.: Nat. Prod. Rep. 23, 394 (2006).
5. Kosuge T, Yokota M, Sugiyama K, Mure T, Yamazawa H, Yamamoto T.: Chem. Pharm. Bull. 33, 5355 (1985).
6. A.Beirith,A.R.Santos,J.B.Calixto,S.C.Hess,I.Messana,F. Ferrari and R.A.Yunes, Planta Med. 65, 50 (1999).
7. Simonsen J., Ross W. C. J.: The Terpenes IV, Cambridge Univ. Press, London 1957.
8. Trumbull E. R., Bianchi E., Eckert D. J., Wiedhopf R. M., Cole J. R.: Pharm. Sci. 65, 1407 (1976).
9. Simonsen J., Ross W. C. J.: The Terpenes. V, Cambridge Univ. Press, London 1957.
10. Urban M., Sarek J., Klinot J., Korinkova G., Hajduch M.: J. Nat. Prod. 67, 1100 (2004).
11. Sarek J., Klinot J., Dzubak P., Klinotova E., Noskova V., Krecek V., Korinkova G., Thomson J. O., Janostakova A., Wang S., Parsons S., Fischer P. M., Zhelev N. Z., Hajduch M.: J. Med. Chem. 46, 5402 (2003).
12. Dzubak P., Sarek J., Anzenbacher P., Masek V., Novak P., Havlicek V., Vydra D., and Hajduch M.: PNAS, in press, 2007.
